刊登在《新英格兰医学期刊》并在2017年欧洲肿瘤内科学会年会上公布的III期PACIFIC试验结果显示,相比安慰剂治疗,PD-L1抑制剂durvalumab(商品名Imfinzi)治疗使放化疗后疾病未进展的不可手术切除的局部晚期(III期)非小细胞肺癌(NSCLC)患者的无进展生存期中值延长了11.2个月(具体数据见下表)。
Durvalumab治疗组
安慰剂治疗组
无进展生存期中值
16.8个月
5.6个月
12个月无进展生存率
55.9%
35.3%
18个月无进展生存率
44.2%
27.0%
对患者总生存期的分析目前尚未进行,所以暂时不知道总生存期数据。
该试验的首席研究员、西班牙Hospital Universitario Doce de Octubre医院的肿瘤内科主席Luis Paz-Ares博士表示:“durvalumab使患者的治疗结果得到了明显改善,具体来说,使患者的无进展生存期延长了约11个月,使患者的缓解率持续提高,使转移性疾病的发生率得以减少。总的说来,durvalumab对经过放化疗的III期NSCLC患者来说是一种有前景的治疗选择。”
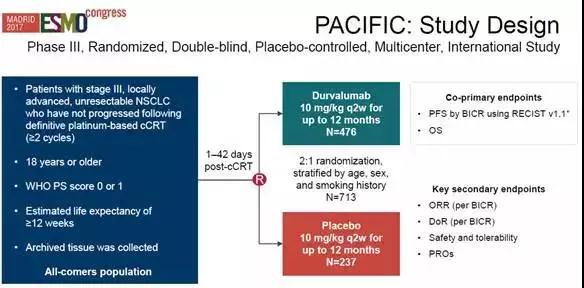
图1 PACIFIC研究设计
PACIFIC试验是唯一使用免疫检查点抑制剂治疗经过放化疗的III期NSCLC患者的III期临床试验,该试验取得的结果对于III期肺癌患者来说是首次重大进展。接受单纯放化疗的患者的无进展生存期中值大约为8~10个月,而在放化疗后再进行durvalumab治疗使患者的无进展生存期中值增加了1倍多。
入组双盲PACIFIC试验的受试者的情况如下:
受试者总体情况
713名不可手术切除的局部晚期(III期)NSCLC患者,均在放化疗后1~42天内入组
l 年龄中值:64岁
l 现时吸烟者或曾吸烟者占比:91%
l 男性患者占比:70.1%
l 鳞状细胞癌患者占比:45.7%
受试者随机分组
Durvalumab治疗组(476人):
l 25.8%的患者在进行针对性放化疗之前接受了诱导化疗
l 放化疗使50.6%的患者达到了客观缓解
l 每两周接受10 mg/kg durvalumab治疗,长达12个月
安慰剂治疗组(237人):
l 28.7%的患者在进行针对性放化疗之前接受了诱导化疗
l 放化疗使49.8%的患者达到了客观缓解
l 接受安慰剂治疗
在该试验中,两组患者的治疗结果对比如下:
Durvalumab治疗组
安慰剂治疗组
客观缓解率
28.4%
16%
完全缓解率
1.4%
0.5%
缓解持续时间中值
未达到
13.8个月
在18个月分析时,继续对治疗产生反应的患者占缓解患者人数的比例
72.8%
46.8%
患者出现死亡或远端转移的时间中值
23.2个月
14.6个月
出现新病灶的患者占比
20.4%
32.1%
出现新的脑部病灶的患者占比
5.5%
11.0%
Paz-Ares博士指出,所有的患者亚组,包括根据PD-L1表达状态进行分类的患者亚组,都取得了类似的无进展生存期获益。相比安慰剂治疗,durvalumab治疗使PD-L1表达<25%的患者的疾病进展或死亡风险降低了41%,使PD-L1表达≥25%的患者的疾病进展或死亡风险降低了59%。
“大多数的患者亚组都具有相同的获益情况,IIIa期和IIIb期患者的获益是相同的,鳞状细胞癌和非鳞状细胞癌患者的获益也是相同的,”Paz-Ares博士讲。“我们还看到PD-L1阳性患者和PD-L1阴性患者的获益是类似的。”
在该试验中,两组患者的不良事件发生率对比如下:
Durvalumab治疗组
安慰剂治疗组
各级不良事件发生率
96.8%
94.9%
3/4级不良事件发生率
29.9%
26.1%
5级不良事件发生率
4.4%
5.6%
治疗相关不良事件发生率
67.8%
53.4%
治疗相关严重不良事件发生率
28.6%
22.6
导致停药的不良事件发生率
15.4%
9.8%
在durvalumab治疗组和安慰剂治疗组中,导致患者停药的最常见不良事件是局限性肺炎或放射性肺炎(6.3% vs. 4.3%)以及肺炎(1.1% vs. 1.3%),最常观察到的特别引人注意的各级不良事件是腹泻(18.3% vs. 18.8%)、局限性肺炎(12.6% vs. 7.7%)、皮疹(12.2% vs. 7.3%)和瘙痒(12.2% vs. 4.7%)。
“Durvalumab的安全性与其他免疫疗法的安全性一致,同时也与其已知作为较晚期疾病患者的单药治疗的安全性一致,”Paz-Ares博士说。“没有发现新的安全性信号。”
根据PACIFIC试验取得的结果,durvalumab的开发商阿斯利康公司已经与全球卫生部门就批准durvalumab事宜进行了讨论。2017年7月,durvalumab获得了FDA突破性疗法认定,用作放化疗后无疾病进展的不可手术切除的局部晚期NSCLC患者的潜在治疗。Durvalumab已获批用于治疗晚期尿路上皮癌患者。
关于Durvalumab
• 获批时间:2017年5月1日
• 靶点:程序性死亡蛋白-1(PD-1)
• 适应症:含铂类药化疗期间或化疗后疾病进展,或含铂类药化疗的新辅助治疗或辅助治疗的12个月内疾病进展的局部晚期或转移性尿路上皮癌。
• 用量:推荐剂量为一次10mg/kg,每2周1次,持续用药至出现疾病进展或不可耐受的毒性。
• 配制与贮存:以0.9%或0.45%氯化钠注射液250ml稀释至终浓度为1mg/ml-15mg/ml。稀释后的药液于室温(25℃)下保存不超过4小时,于2-8℃下保存不超过24小时。不得冷冻;不得振摇。
• 使用方法:静脉滴注时间为60分钟以上。
咨询癌症药物及癌症专家,请登录或登录全球肿瘤医生网。