百济神州不限癌种的抗癌药替雷利珠单抗注射液(百泽安、Tislelizumab、Tevimbra)在美国开出首张处方,1年生存率近40%
近日,由百济神州(北京)生物科技公司自主研发的一款不限癌种的抗癌药——替雷利珠单抗,已于2024年10月下旬在美国开出首张处方,这也标志着我国自研的PD-1抑制剂正式进军国际市场!早在2024年3月,替雷利珠单抗就已正式获得美国FDA(食品药品监督管理局)批准,用于既往接受过系统化疗(不含PD-1/L1抑制剂)的成人不可切除或转移性食管鳞状细胞癌(ESCC)的治疗。
抗癌小能手-替雷利珠单抗,已在多国获批上市
替雷利珠单抗(Tislelizumab,百泽安®,TEVIMBRA®,)是一款在研的人源化免疫球蛋白G4单克隆抗体,对PD-1具有高亲和力,能精准地作用于免疫系统与癌细胞之间的关键靶点,如同一位技艺高超的战略家,巧妙地指挥免疫系统的“士兵”——免疫细胞,打破癌细胞的防御机制,重新激活人体自身的抗癌防线,帮助免疫系统精准识别并及时杀伤肿瘤细胞。
目前,替雷利珠单抗已在美国、英国、欧盟、韩国、澳大利亚、瑞士、中国等地相继获批,用于治疗胃或胃食管结合部(G/GEJ)癌、非小细胞肺癌、食管鳞状细胞癌(ESCC)等。其中,替雷利珠单抗在中国的获批适应证已达到14个,包括2024年10月21日刚刚获批的新适应症,即用于治疗Ⅱ期或Ⅲ期非小细胞肺癌(NSCLC)。
值得一提的是,替雷利珠单抗已有11个适应证被纳入国家医保药品目录,它也成为了目前我国纳入医保药品目录及获批适应症数量最多的一款PD-1抑制剂。
替雷利珠单抗3期临床结果惊艳,1年生存率近40%
替雷利珠单抗本次在美国获批,主要是基于一项III期RATIONALE-302临床研究(NCT03430843)的惊艳数据。本次研究共入组512例一线全身治疗后,肿瘤进展的晚期或转移性晚期或转移性食管鳞状细胞癌(ESCC)患者,将其随机分为两组,即替雷利珠单抗组、化疗组(紫杉醇、伊立替康或多西他赛)。结果显示:
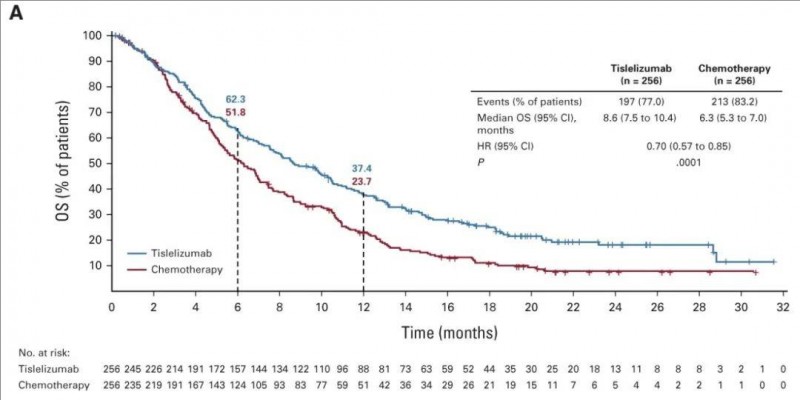
1、中位总生存期(OS):替雷利珠单抗组的中位总生存期(OS)显著优于化疗组,分别为8.6个月(替雷利珠单抗组) vs 6.3个月(化疗组),详见下图。此外,12个月的OS率分别为37.4%(替雷利珠单抗组) vs 23.7%(化疗组)。
▲图源“JCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
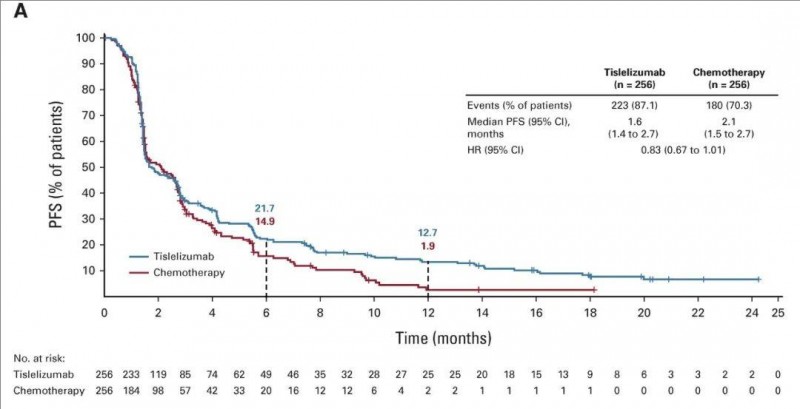
2、中位无进展生存期(PFS):中位PFS分别为1.6个月(替雷利珠单抗组) vs 2.1个月(化疗组),详见下图。但替雷利珠单抗在6个月和12个月的PFS率明显更具优势,6个月的预计PFS率则为21.7%(替雷利珠单抗组) vs 14.9%(化疗组)。12个月的预计PFS率分别为12.7%(替雷利珠单抗组) vs 1.9%(化疗组)。
▲图源“JCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
上述研究数据再次验证了,替雷利珠单抗作为晚期或转移性食管鳞状细胞癌(ESCC)的二线治疗方案,可显著改善患者的生存期,且安全性可控,这也是我国自研的替雷利珠单抗能顺利进军美国的重要原因。
更难能可贵的是,替雷利珠单抗作为一款“不限癌种”的抗癌新药,除了食管癌外,它在治疗胃癌、肺癌等方面,也展现出了不俗的实力。在未来,我们也期望这一药物能创造更多的奇迹,让更多患者在与癌症的抗争中重获生机与希望。
除了替雷利珠单抗外,还有多款PD-1/PD-L1抑制剂已获批上市或正在开展临床研究,想参加临床新药试验或了解替雷利珠单抗更多适应证的患者,可将近期影像学及病理检查结果、出院小结、治疗经历等资料,提交至医学部,进行初步评估或者通过方舟计划寻求免费用药的机会!
参考资料
[1]Shen L,et al. Tislelizumab versus chemotherapy as second-line treatment for advanced or linkstatic esophageal squamous cell carcinoma (RATIONALE-302): a randomized phase III study[J]. Journal of clinical oncology, 2022, 40(26): 3065-3076.
https://ascopubs.org/doi/10.1200/JCO.21.01926