2024年10月16日国家药监局批准PD-1抑制剂替雷利珠单抗(百泽安、Tislelizumab、BGBA317)用于Ⅱ期或Ⅲ期非小细胞肺癌
2024年10月21日),肺癌患者又迎来一个重磅好消息,百济神州研发的PD-1抑制剂——替雷利珠单抗,正式获得中国国家国家药品监督管理局(NMPA)的批准,用于Ⅱ期或Ⅲ期非小细胞肺癌(NSCLC)的治疗。
替雷利珠单抗也成为了我国首个获批用于II~III期非小细胞肺癌(NSCLC)新辅助+辅助免疫治疗的PD-1药物,这也意味着对其他PD-1抑制剂耐药的NSCLC患者,终于有了新的希望和选择!
▲截图源自“NMPA”
替雷利珠单抗联合新辅助化疗,非小细胞肺癌MPR率高达56.2%
替雷利珠单抗的本次获批主要是基于2024 ESMO大会上公布的RATIonALE 315 Ⅲ期临床研究(NCT04379635)的惊艳数据。
本次研究共入组453例既往接受过铂类双药化疗的II-IIIA期可切除的非小细胞肺癌(NSCLC)患者(无EGFR或ALK突变),并将其分为两组,即TIS组(n=226,接受替雷利珠单抗+化疗)、安慰剂组(n=227)。结果显示如下:
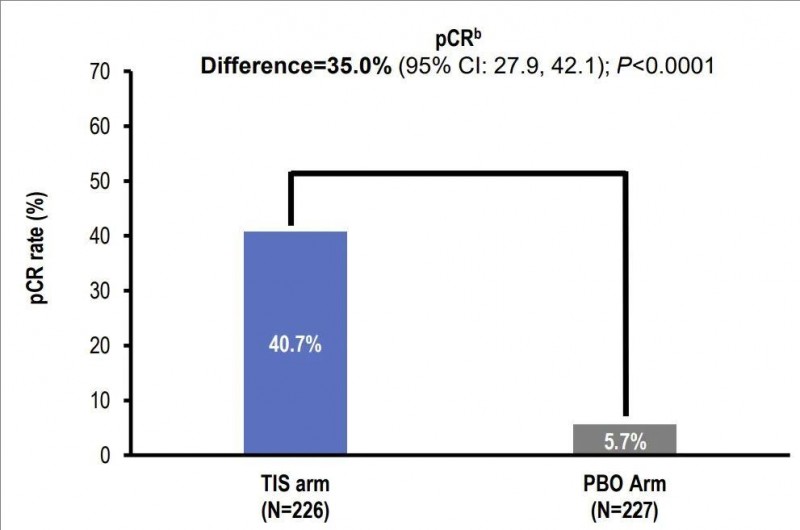
1、病理学完全缓解率(pCR率):替雷利珠单抗联合新辅助化疗显著提高了病理学完全缓解率(pCR率),pCR率分别为40.7%(TIS组) vs 5.7%(安慰剂组)。
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、主要病理学缓解率(MPR率):MPR率为56.2%(TIS组) vs 15.0%(安慰剂组),显然替雷利珠单抗显著提高了MPR率。
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
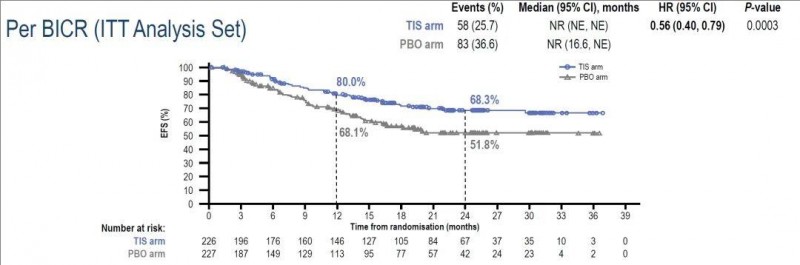
3、无事件生存期(EFS):替雷利珠单抗还延长了患者的无事件生存期(EFS)(HR 95% CI:0.56,0.40~0.79)。
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
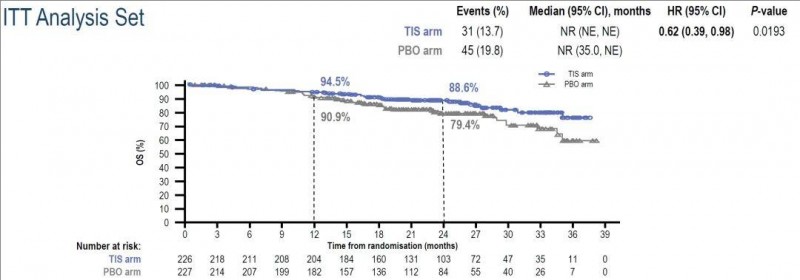
4、总生存期(OS):OS也有延长的趋势[HR (95% CI),0.62(0.39–0.98);单侧P= .0193]。
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,围术期应用替雷利珠单抗+新辅助化疗联合治疗,可显著降低非小细胞肺癌患者围术期病情进展或复发转移的风险。
小编寄语
截至目前,替雷利珠单抗(Tislelizumab,BGB-A317,百泽安®)在我国获批的适应证已经达到了14个,其中11个适应证已纳入国家医保药品目录,该药也是截至目前获批适应症数量及纳入医保药品目录适应证数量最多的一款PD-1抑制剂。
PD-1作为一个常见的靶点,在多种癌症中都有表达。除了替雷利珠单抗外,还有多款PD-1抑制剂已经获批或正在开展临床研究,想了解替雷利珠单抗更多获批适应证或参加临床新药试验的患者,可将治疗经历、近期影像学及病理检查结果等资料,提交至医学部,进行初步评估或通过方舟计划寻求免费用药的机会!
参考资料
[1]Yue, D.et al.VP1-2024: RATIONALE-315: Event-free survival (EFS) and overall survival (OS) of neoadjuvant tislelizumab (TIS) plus chemotherapy (CT) with adjuvant TIS in resectable non-small cell lung cancer (NSCLC).Annals of Oncology, Volume 35, Issue 3, 332 - 333.
https://www.annalsofoncology.org/article/S0923-7534(24)00012-7/fulltext
[2]https://www.nmpa.gov.cn/