TCR-T细胞疗法治疗实体瘤无瘤生存超9年,成为新一代抗癌利器,预计8月首款产品上市
近些年来,以基因修饰T细胞为中心的过继细胞疗法(ACT)引起全世界广泛的关注,其中包括大众熟知的CAR-T疗法和TCR-T疗法。CAR-T疗法在血液肿瘤中取得了卓越的疗效,但在实体瘤中的治疗效果却差强人意。在这方面,TCR-T治疗在实体肿瘤中具有非常大的发展潜力。
TCR-T细胞免疫疗法是继淋巴因子活化的杀伤细胞(LAK)和肿瘤浸润淋巴细胞(TIL)免疫疗法之后,针对性更强的一种细胞免疫治疗方法。
TCR-T的成功应用要追溯到2006年,Rosenberg小组在《Science》上发表的一篇文章中显示,经基因修饰的TCR-T细胞在黑色素瘤的治疗中显示了较好的应用前景——参与试验的17名患者中,有2人出现了抗肿瘤响应,这次研究首次证明TCR-T对实体瘤显示出巨大的潜力。TCR-T技术主要机制是向普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR(T cell receptor,T细胞抗原受体),从而引导T细胞杀死肿瘤细胞。
作为近年来的研究热点,TCR-T疗法目前在国内外正处于如火如荼的临床验证阶段,尤其是在实体瘤方面取得的成绩可谓是大放异彩。接下来,无癌家园小编就给各位癌友们详细报道下相关临床研究。
无瘤生存超9年!TCR-T疗法对复发难治HPV阳性宫颈癌初有成效!
宫颈癌是继子宫癌后第二大威胁女性生殖器官的恶性肿瘤,超95%的患者是由高危亚型人乳头瘤病毒(HPV)感染引起的,因此迫切地开发晚期宫颈癌的治疗方法迫在眉睫,其中细胞免疫疗法成为治疗恶性癌症的新治疗选择。
多抗原刺激细胞疗法 (MASCT) 是一种结合树突状细胞 (DC) 和自体 T 细胞的免疫治疗方法。TCR-T 疗法的主要挑战之一是识别具有高亲和力和特异性的 TCR,然而,具有高亲和力的天然 TCR 很少见。长期存活的患者被认为是识别具有高效力的天然治疗性 TCR 的宝贵来源。因此,研究人员已成功从接受MASCT治疗的癌症患者中鉴定出肿瘤抗原特异性TCR。
HRYZ-T101为全球首创新药,是一款靶向HPV18阳性实体瘤的TCR-T产品,其患者治疗效果的研究结果公布在近期国外知名杂志《Nature Communications》上。
截图源自《Nature Communications》
该研究中提及到一名在2011年被诊断为HPV阳性晚期转移性宫颈鳞状细胞癌患者,经手术、化疗、放疗等常规治疗后复发。患者于2014年起,经过多疗程MASCT治疗后肿瘤逐渐消退并获得长期缓解,截至目前已无瘤生存超过九年。该患者体内针对HPV18 E7等多种肿瘤抗原特异性T细胞的长期存在是该患者临床获益的可能原因。
预计8月上市!全球首款实体瘤TCR-T疗法获FDA优先审评资格!
2024年1月31日,国际医学领域传来一则振奋人心的消息!专门采用针对MAGE-A4癌症抗原的TCR-T技术afamitresgene autoleucel(Afami-cel,以前称为ADP-A2M4)生物制品许可申请(BLA)获FDA受理并获得了优先评审资格,拟用于治疗晚期滑膜肉瘤。
截图源自Adaptimmune官网
该申请的PDUFA日期为2024年8月4日。如果获得批准,Afami-cel将有望成为首款实体瘤的工程化T细胞疗法,也是首款TCR-T疗法,具有重要的里程碑意义。值得一提的是,这也是十多年来治疗滑膜肉瘤的首个有效疗法。
该试验中的滑膜肉瘤患者均患有晚期转移性疾病,接受过中位线为3线的系统性治疗。此次数据强化了Afami-cel的临床疗效和可接受的安全性,截止到2022年8月29日数据截取:
总共52例患者[44例滑膜肉瘤,8例黏液样/圆形细胞脂肪肉瘤(MRCLS)]接受了Afami-cel治疗,客观缓解率为36.5%(其中滑膜肉瘤为38.6%,MRCLS为25.0%),疾病控制率为88.4%。滑膜肉瘤的缓解中位持续时间约为12个月。最新生存分析显示,中位随访时间为27.8个月时,中位持续反应时间为11.6个月。
晚期滑膜肉瘤的历史结果很差,二线治疗的客观缓解率较低,并且先前接受过两次或两次以上治疗的患者的总生存期不到12个月。该试验达到了其主要疗效终点,并已在2023年结缔组织肿瘤学会 (CTOS) 年会上公布。在经过大量预先治疗的晚期滑膜肉瘤患者中,客观缓解率为39%,中位生存期约为17个月,优于历史对照数据。接受Afami-cel治疗有缓解的晚期滑膜肉瘤患者中,70%的人在治疗两年后仍然存活。
惊艳!全球首项针对乙肝病毒抗原的TCR-T疗法闪耀国际
乙肝病毒(HBV)-T细胞受体(TCR)T细胞免疫疗法在HBV相关肝细胞癌(HBV-HCC)患者中的应用一直不温不火,因为正常的HBV感染肝细胞和HBV-DNA整合的HCC细胞都会表达HBV抗原,这会增加肿瘤外严重肝脏炎症事件的风险。为了提高这种免疫治疗方法的安全性,研究人员开发信使RNA(mRNA)HBV-TCR重定向T细胞,由于mRNA的瞬时性质,这种细胞在功能上寿命很短,可以逐渐增加输注的剂量。
基于来恩生物创始人研发的全球首个靶向HBV抗原的特异性T细胞受体(TCR)的T细胞疗法,我国研究人员与其合作,启动了全球第一项针对HBV抗原的特异性TCR-T细胞治疗肝细胞癌的临床试验,并在2022年的美国肝病研究学会年会(AASLD)上以壁报的形式报道了其最新研究进展。
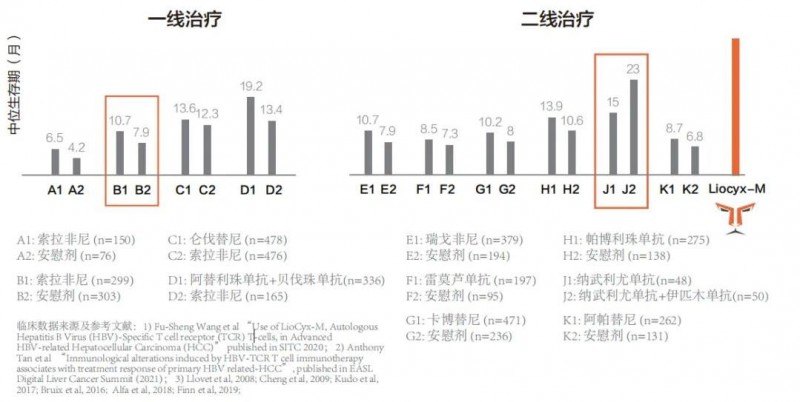
此项试验是I期剂量递增研究,中国北京解放军总医院第五医学中心招募了8例原发性HBV-HCC患者,第一个治疗周期输注四次LioCyx-M,输注剂量为1×10^4、1×10^5、1×10^6和5×10^6细胞/kg体重,1次/周。如果没有药物相关毒性,患者继续接受每周5×10^6细胞/kg体重的给药。治疗结束后长期随访5年。
根据RECIST 1.1评估,1例患者在治疗后达到部分缓解(PR),并且缓解期持续了27.7个月;另外有3例患者达到疾病稳定(SD),其中2例SD分别维持了3个月和9.4个月。
基于临床反应将患者分为疾病进展组(PD或SD<3个月,n-3)、疾病缓解组(n=5)。截至2022年1月18日,受试者总生存期(OS)中位数为33.1个月。疾病缓解组显示出较大程度的可逆性局部肝脏炎症,通过治疗谷丙转氨酶(ALT)水平的变化来测量,表明LioCyx-M的靶向效应,并伴有明显的肿瘤缩小及抗病毒效应。疾病缓解组有4例患者出现相对于基线水平的HBsAg下降,而疾病进展组仅有1例患者有此反应。
图源来恩生物
与索拉非尼的历史数据比较,来恩的LioCyx-M产品的中位生存期的临床数据获得显著提升,翻了3倍!
目前无癌家园有多项TCR-T疗法的临床试验正在进行招募,想要参加的患者可以拨打无癌家园医学部了解详细入排标准。
急招以下癌种:
1.乙型肝炎病毒相关肝细胞癌;
2.靶向KRAS突变的T细胞受体基因工程改造T细胞疗法(结直肠癌、胰腺癌、肺腺癌等实体瘤);
3.靶向HPV16阳性的既往治疗失败的复发或者转移性宫颈癌!
此外,若想咨询其他细胞疗法(CAR-T、NK、CAR-NK、CTL、TILs等疗法)的患者,同样可将病理报告及治疗经历、出院小结等资料提交至无癌家园医学部,详细评估病情。
67%的肝癌患者生存期超2年!国产实体瘤TCR-T疗法大显身手!
2023年11月13日,创新免疫疗法公司星汉德生物在在美国波士顿举行的美国肝病协会年会(AASLD-The Liver Meeting)上,该公司的乙型肝炎病毒(HBV)特异性的TCR-T细胞疗法SCG101入选最新突破(Late-breaking)临床研究。
图源来自BioSpace官网
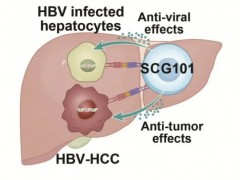
SCG101是一种乙肝抗原特异性的TCR-T细胞疗法,可以特异性靶向HBV抗原相关T细胞表位,有效清除HBV-HCC肿瘤细胞、HBV-DNA整合的癌前病变细胞和HBV感染细胞。
根据本次在AASLD年会公布的内容,6例晚期HBV相关肝癌患者接受了单次5.0×10^7~1.0×10^8/kg TCR+ T细胞输注,在2例患者达到部分缓解(PR)中,有1例患者肝病灶达到病理完全缓解(pCR),另外2例患者疾病稳定(SD)并观察到肿瘤缩小。
研究分析显示,患者的肿瘤应答与SCG101的抗病毒活性高度相关。研究中全部患者(100%)接受SCG01治疗后均观察到血清HBsAg下降,其中有4例患者更观察到1~3log的血清HBsAg显著降低,并维持在低水平长达90周(至数据截止日),没有反弹。同时,至数据截止日,该4例患者均观察到肿瘤缩小,且无进展生存期(PFS)显著延长至25.8周(超过2年)。
此前,SCG101于2022年3月获得中国国家药品监督管理局(NMPA)和2022年5月获得新加坡卫生科学局(HSA)的IND批准,进一步确立了SCG101作为同时在美国、中国和新加坡批准进行临床试验的TCR-T细胞治疗产品。
2022年6月底,SCG101获得FDA临床试验许可,将在美全面展开SCG101的I/II期临床试验,系统评估SCG用于乙肝病毒(HBV)相关肝细胞癌(HCC)患者的安全性和有效性。
个性化新型TCR-T疗法缩小结直肠癌病灶,已7个月未生长!
近期,美国国立卫生研究院(NIH)的研究人员进行了一项小型的TCR-T临床试验,并将研究结果发表在《Nature Medicine》上,该研究结果显示,通过个体化新型TCR-T疗法,使转移性结直肠癌患者的重量病灶显著缩小,且在7个月内未重新生长。
在这项2期研究中,共纳入7例转移性、错配修复结直肠癌患者,他们既往接受多次治疗,但病情仍然进展。结果显示,临床客观缓解率达42.8%(3/7),肝转移、肺转移和淋巴结转移均显著消退,并持续 4 ~7个月。这一试验初步证实了TCR-T疗法治疗转移性实体瘤(转移性结直肠癌)令人振奋的潜能。
该文的作者Steven Rosenberg博士表示,通过将正常淋巴细胞转化为能够治疗常见实体瘤的细胞,让不断生长的转移性实体瘤有所消退,能够充分说明新型细胞免疫疗法是具有前景的治疗方式。
客观缓解率达40%!靶向NY-ESO-1抗原的TCR-T疗法大显身手!
Lete-cel 是一种自体工程化 T 细胞受体疗法,靶向在滑膜肉瘤 (SyS) 和粘液样/圆细胞脂肪肉瘤 (MRCLS) 中高度表达的 NY-ESO-1 癌症睾丸抗原。Lete-cel 试点研究在表达 NY-ESO-1 的 SyS 或 MRCLS 患者 (pts) 中显示出良好的疗效。
此次2024年ASCO大会上国际研究人员口头报告了靶向NY-ESO-1实体瘤抗原的工程化T细胞受体(TCR)-T细胞疗法在滑膜肉瘤和黏液样/圆细胞脂肪肉瘤中的2期临床研究结果。
▲截自《Journal of Hematology & Oncology》
该研究纳入98例滑膜肉瘤和MRCLS患者,其中45例患者可评估疗效。结果显示,总体客观缓解率(ORR)为40%(包括2例完全缓解,16例部分缓解),其中滑膜肉瘤和MRCLS患者的ORR分别为39%和41%。中位反应持续时间为10.6个月。在该研究中,不良事件与先前观察到的一致。
上述研究的疗效及安全性支持了lete-cel作为晚期或转移性 SyS 和 MRCLS 患者的新疗法的潜力。
对HPV-16 阳性实体瘤的TCR-T疗法,让难治性患者部分缓解
吉利德公司在2018年ASCO年会上公布了其公司在研TCR-T疗法KITE-439治疗HPV阳性实体瘤的临床1期试验的早期数据,该研究表明,靶向16型HPV(HPV-16)的E7蛋白的TCR疗法能够在部分HPV-16阳性癌症患者身上实现肿瘤部分缓解。
研究证实,90%以上的宫颈癌均与HPV(人乳头瘤病毒)相关,而HPV病毒包含100多种亚型,其中以16型和18型最为常见。除此之外,HPV感染还会导致多种头颈癌和肛门生殖器肿瘤。目前,HPV相关癌症通常无法治愈,通过标准疗法无法改善。因此,研究人员们将目光投向TCR-T细胞疗法。
由于HPV导致的上皮癌的肿瘤细胞会表达叫做E7的蛋白,因此这些患者一旦接受标准疗法后癌症复发或产生抗体,便无可用疗法进行治愈。
KITE-439是一种靶向E7蛋白的TCR-T疗法,此次试验共有8例转移性HPV-16阳性肿瘤患者接受治疗,这些患者在治疗前均接受过3~7种全身性癌症治疗。
结果显示,在7例可评估的患者中,3例部分缓解,2例患者疾病稳定。截止数据发布时,缓解期最长可以达到9个月,获得部分缓解的患者分别为外阴癌、口咽癌和肛门癌患者,其中2名患者曾经接受过抗PD1免疫检查点抑制剂治疗。此外,该研究没有出现限制疗法剂量的毒副作用。
小编有话说
TCR-T疗法治疗肿瘤是一个令人兴奋且发展迅速的新兴领域。它的使用开创了一种治疗癌症、病毒感染和其他免疫调节疾病的新方法。临床研究已经证明了使用TCR-T治疗癌症和病毒感染的不同程度的可行性、安全性和有效性。尽管有证据表明TCR-T可以是安全有效的,但如何最大限度地发挥其治疗潜力并将不良事件降至最低仍有待研究。
到目前为止,TCR-T 细胞免疫疗法已在部分实体肿瘤的治疗中取得了较好的疗效,特别是对肝癌、黑素瘤、滑膜细胞肉瘤的治疗效果很明显,但是对食管癌和多发性骨髓瘤等其他实体瘤的疗效尚有待进一步临床验证。希望在不久的将来,经过科研人员的不懈努力,选择到更合适的免疫靶标,并且优化TCR-T 的转染等方式。TCR-T疗法必将在癌症、传染病或自身免疫病等领域发挥重要作用。