2024年3月6日FDA正式批准PD-1抑制剂纳武利尤单抗(Nivolumab、欧狄沃/Opdivo)联合化疗用于一线治疗尿路上皮癌
2024年3月6日美国食品药品监督管理局(FDA)批准纳武利尤单抗(Nivolumab、欧狄沃/Opdivo)联合顺铂和吉西他滨,一线治疗不可切除或转移性尿路上皮癌(UC)患者。这一决定不仅标志着对现有治疗方案的重大改进,也为患者提供了更多的生存希望。
获批依据
此次纳武利尤单抗联合化疗的获批,主要基于CHECKMATE-901研究的阳性结果,这是一项随机、开放标签、3期临床试验,旨在评估纳武利尤单抗联合顺铂和吉西他滨一线治疗不可切除或转移性尿路上皮癌患者的疗效和安全性。
研究设计:
纳入人群:608例既往未经治疗的不可切除或转移性UC患者;
分组:1:1随机分配至纳武利尤单抗联合化疗组或化疗组。
治疗方案:
纳武利尤单抗联合化疗组:纳武利尤单抗联合顺铂和吉西他滨(最多6个周期),随后单独接受纳武利尤单抗治疗长达两年
化疗组:顺铂和吉西他滨(最多6个周期)
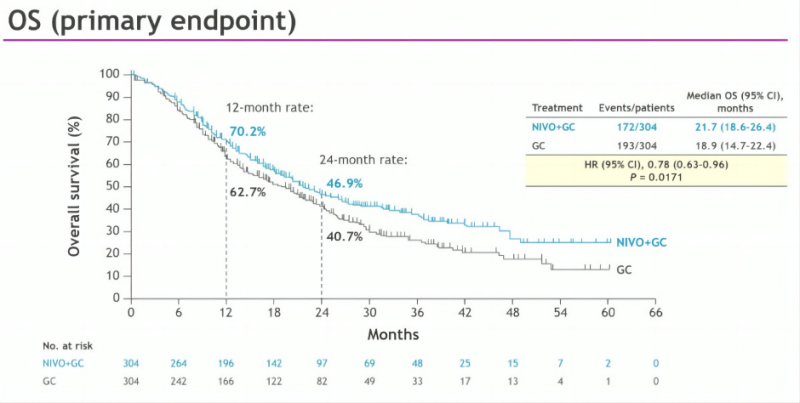
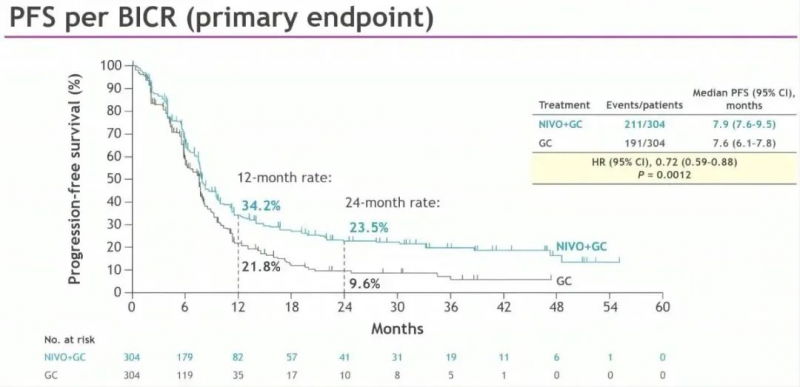
主要终点:总生存期(OS)和无进展生存期(PFS)
研究结果:
总生存期(OS):纳武利尤单抗联合化疗组的中位OS为21.7个月,化疗组为18.9个月,死亡风险降低22%(HR 0.78, 95% CI: 0.63-0.96, P=0.0171)。
无进展生存期(PFS):纳武利尤单抗联合化疗组的中位PFS为7.9个月,化疗组为7.6个月,疾病进展或死亡风险降低28%(HR 0.72, 95% CI: 0.59-0.88, P=0.0012)。
客观缓解率(ORR):纳武利尤单抗联合化疗组为57.6%,化疗组为43.1%。
安全性:纳武利尤单抗联合化疗组最常见的≥15%不良反应包括恶心、疲劳、肌肉骨骼疼痛、便秘等。
纳武利尤单抗简介
纳武利尤单抗是一种PD-1抑制剂,通过阻断PD-1与其配体的结合,解除肿瘤细胞对免疫系统的抑制,从而激活T细胞对肿瘤细胞的杀伤作用。
与化疗联合协同增效
化疗可以直接杀死肿瘤细胞,而纳武利尤单抗则通过激活免疫反应,进一步清除残余肿瘤细胞。这种联合疗法在多种癌症治疗中显示出协同增效作用,可以提高患者的总体生存率,并可能改善生活质量。
改变尿路上皮癌的治疗格局
纳武利尤单抗联合化疗的获批,改写了不可切除或转移性尿路上皮癌患者的治疗格局,为患者带来了新的希望。未来,纳武利尤单抗有望与其他药物联合,为UC患者提供更多治疗选择。
治疗尿路上皮癌的获批历程
2017年2月2日,FDA批准纳武利尤单抗用于含铂类化疗中/后疾病进展或含铂类新辅助/辅助化疗12个月内疾病进展的局部晚期或转移性尿路上皮癌。
2021年8月19日,FDA批准纳武利尤单抗作为辅助疗法治疗根治手术后高危的尿路上皮癌患者。
2024年3月6日,FDA批准纳武利尤单抗联合顺铂和吉西他滨一线治疗不可切除或转移性尿路上皮癌成人患者。
结语
纳武利尤单抗联合化疗的获批,为不可切除或转移性尿路上皮癌患者带来了新的治疗希望,未来,随着免疫治疗研究的不断深入,相信会有更多创新疗法问世,为UC患者带来更长的生存期和更好的生活质量。