2024年7月5日中国批准口服XPO1抑制剂塞利尼索片(Selinexor、希维奥、ATG-010、Xpovio)用于复发/难治性弥漫大B细胞淋巴瘤
2024年7月5日,中国国家药品监督管理局(NMPA)批准塞利尼索片(Selinexor、希维奥、ATG-010、Xpovio)作为单一疗法,用于复发/难治性弥漫大B细胞淋巴瘤(R/R DLBCL)成年患者的治疗。这是该药在中国获批的第二项适应证,在中国获批的首个适应证是复发/难治性多发性骨髓瘤(R/R MM)的治疗。
值得一提的是,Selinexor口服即可,患者可遵医嘱在家完成治疗,从而减轻了住院负担。目前该药已在全球40多个国家和地区获得批准(包括美国FDA),并被纳入中国大陆、韩国、新加坡、澳大利亚等国的医疗保险范围,为血液肿瘤患者带来了新的曙光与选择!
Selinexor:弥漫性大B细胞淋巴瘤的新选择,完全缓解率达13%
▲截图源自“OneLive”
弥漫性大B细胞淋巴瘤(DLBCL)是成人最常见的非霍奇金淋巴瘤亚型之一,侵袭性较强。目前DLBCL的标准治疗是免疫治疗,患者5年无进展生存率为60%~65%,治愈率为40%~50%。但仍有10%-15%的患者对标准一线治疗无反应,预后不良,因而迫切需要寻找新的治疗方法与药物。
Selinexor(塞利尼索片,ATG-010,Xpovio®)是一种口服选择性核输出抑制剂,可阻断输出蛋白1(XPO1),它是全球首个获批的口服选择性XPO1抑制剂。Selinexor本次获中国NMPA批准,得益于II期SEARCH临床研究(NCT03992339)的数据支持,在60名接受口服XPO1抑制剂治疗的中国患者中,展现出了持久且显著的缓解、较长的生存期,并达到了预先指定的总体反应率(ORR)主要终点。总之,中国患者接受selinexor单药治疗后,展现出了明确的疗效。
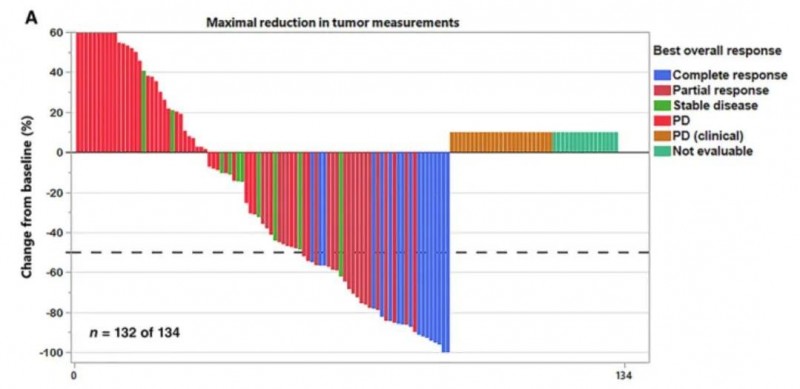
此前,selinexor在2b期SADAL临床研究(NCT02227251)中,就已展现了不俗的成绩。在入组的134例可评估疗效的患者中,中位年龄为67岁,75%的患者患新发弥漫性大B细胞淋巴瘤(DLBCL)、23%的患者为源自低度淋巴瘤的DLBCL。63%的患者既往接受过2种(中位数)全身治疗,34%的患者接受过3~5种治疗。结果显示如下:
1、客观缓解率(ORR):134名患者中有39名获得客观缓解,ORR达到29%。其中38%的患者缓解持续时间≥6个月,15%的患者缓解持续时间≥12个月(详见下图)。
▼Kaplan-Meier预估的反应持续时间(n=39)
▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、完全缓解(CR):13%的患者幸运地获得了完全缓解(CR)。
▼最佳总体反应瀑布图
▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,Selinexor可作为复发或难治性弥漫性大B细胞淋巴瘤的三线或以上治疗选择,且毒性通常可控,为恶性血液肿瘤患者博得了“一线生机”!