免疫+靶向治疗,一线无化疗用免疫加靶向治疗也能无癌超2年,这类免疫治疗联合靶向治疗的非小细胞肺癌临床试验正在招募患者
关于非小细胞肺癌的生存期,有些专家认为,晚期非小细胞肺癌患者用靶向治疗的平均寿命在1.5~3年左右,近几年有所延长;也有的专家指出,非小细胞肺癌患者的生存期因驱动基因突变类型不同而差异极大,部分类型的患者中位总生存期可以达到7年以上。
在非小细胞肺癌当中,约40%~70%的患者存在可用于靶向治疗的驱动基因突变,部分亚型(如肺腺癌)当中更高。随着靶向治疗新药的发展,这个比例正在逐年提高。
不过,并非所有非小细胞肺癌患者都适合使用靶向治疗。部分没有驱动基因突变的患者,甚至是耐药等原因无法接受靶向治疗的患者,都需要考虑接受免疫治疗。好在免疫检查点抑制剂治疗非小细胞肺癌的疗效同样出色,尤其是其代表性的生存期“长尾”图像,提示部分“超级幸存者”有希望通过免疫治疗长期生存。
这一次,基因药物汇就来带大家了解几类PD-L1抑制剂在非小细胞肺癌治疗当中的效果,并公告部分药物的临床试验招募信息。
三代ALK抑制剂均耐药?免疫治疗突破"低效突变"
一位41岁的女性患者于2014年12月确诊Ⅳ期肺腺癌(pT2N0M1a),ALK阳性,EGFR及ROS1阴性。
在2015至2020年间,患者接受了三代ALK抑制剂的序贯治疗,这一靶点的靶向治疗方案为她带来了五年的生存期。其中,2015年2月至2016年9月期间患者接受了第一代ALK抑制剂克唑替尼治疗,2016年9月至2017年7月期间患者接受了第二代ALK抑制剂色瑞替尼治疗,在耐药后接受第三代ALK抑制剂劳拉替尼治疗至2020年7月。
但随后,患者的病情开始迅速进展。患者开始出现尿潴留、骶骨剧烈疼痛,导致失去行动的能力,并造成了部分皮肤区域感觉异常。此时,患者出现了淋巴结转移,广泛的骨转移及肝转移,ALK阳性,在SP142检测中发现PD-L1阴性,但在22C3检测中提示PD-L1表达较高(≥50%)。
从2020年7月14日开始,患者开始接受阿特珠单抗(Atezolizumab,一款PD-L1抑制剂)+贝伐珠单抗(抗血管生成抑制剂)+培美曲塞+卡铂方案治疗。
仅接受治疗1个周期,患者的症状开始改善,尤其是疼痛及感觉异常有了明显的缓解,肿瘤标志物癌胚抗原(CEA)和Ca19-9水平明显降低。
治疗4个周期后,患者的肝转移病灶完全缓解,骨转移病灶达到了部分缓解;此时患者已经恢复了独立行走的能力,疼痛及感觉异常明显好转!
当然,绝大多数情况下我们并不建议EGFR或ALK等驱动基因阳性的患者去使用免疫检查点抑制剂治疗。这一案例主要用于展示,即使是在“低效基因突变”阳性的情况下,一旦患者对免疫+抗血管+化疗的方案敏感,同样可以得到非常出色的疗效!
一线无化疗,也能完全缓解超过2年
一位77岁的男性转移性肺鳞癌患者,吸烟史30年,右下肺癌,多部位肌内转移,纵隔淋巴结转移、肠系膜转移。使用SP263测定患者的肿瘤细胞PD-L1表达为60%。由于患者拒绝化疗,因此一线治疗选择了得瓦鲁单抗(Durvalumab,一款PD-L1抑制剂)单药方案。
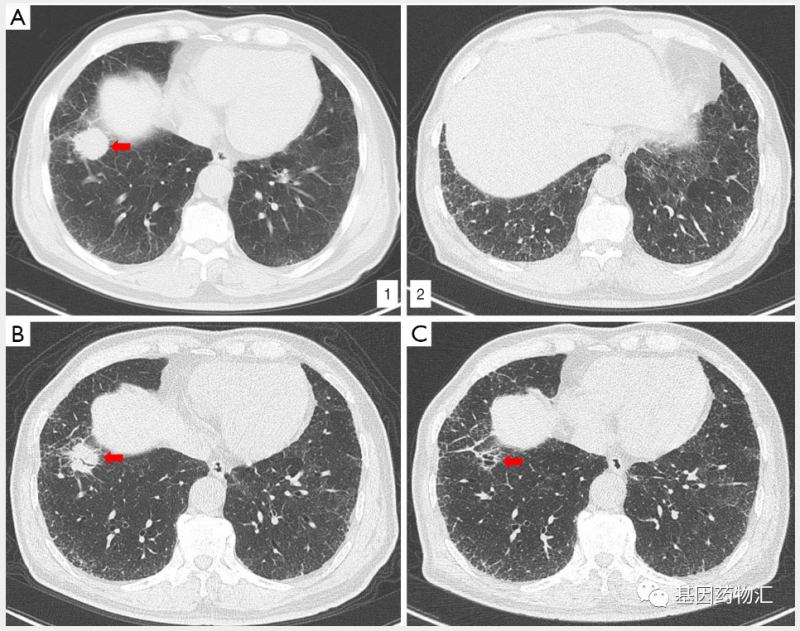
从2018年1月开始,治疗4个周期后,患者达到了部分缓解;治疗6个周期后,患者达到了完全缓解!至2年后,2020年3月复查时,患者仍然保持着完全缓解。
(A1)确诊时原发病灶;(A2)双侧肺间质性肺病;(B)治疗2个周期后,原发病灶缩小;(C)治疗4个周期后,原发病灶已经消失。
这位患者拒绝了化疗,因此使用的是PD-L1抑制剂单药一线治疗。从疗效上来说,这位患者达到了临床完全缓解,又持续了非常长的时间,绝对有希望成为“超级响应者”,也就是我们所说的,疗效最好的10%的完全缓解以及超长缓解持续期患者。
美国国家癌症研究所(NCI)于2014年启动了“超级响应者计划”,以评估从反应异常的患者中采集肿瘤组织样本、并进行分析的可能性。根据NCI的定义,超级响应者指少于10%的完全缓解者,或少于10%的、持续超过6个月的部分缓解者,或缓解持续时间超过临床试验中相应药物中位缓解持续时间的3倍的患者。
当然,这并非“超级响应者”的唯一定义。其他癌症中心对于超级响应者也存在其他定义,如完全缓解超过1年,或患者的部分缓解及疾病稳定状态在疾病的任何阶段持续超过2年。
从这两个病例、尤其是后面一位“超级响应者”的病例当中,我们已经窥见PD-L1抑制剂在非小细胞肺癌当中的出色表现。那么接下来,我们就来一起了解一些与PD-L1抑制剂方案相关的知识。
什么是PD-L1?和PD-1的区别是什么?
提到PD-L1,就不得不提一下PD-1。这两个免疫检查点的名字很相似,功能也密不可分——PD-1和PD-L1是一对配体,在互相结合的状态下会发挥一定的免疫调控作用。
其中PD-1位于免疫细胞(通常是T淋巴细胞等)的表面,PD-L1位于正常细胞或癌细胞的表面。两个配体结合的时候,免疫细胞会得到一个抑制信号:“这个携带了PD-L1的细胞不能杀!”
因此,不论是使用PD-1抑制剂还是PD-L1抑制剂,都会阻断这种抑制信号,让免疫细胞保持旺盛的杀伤癌细胞的能力。也正是因此,如果患者癌细胞的PD-L1表达比例比较高,那么使用这两类免疫检查点抑制剂的疗效就会更好。
但是不同的作用机理,也让这两类药物的实际应用有了一些细微的差异。
根据作用原理,使用PD-L1抑制剂的时候,我们将期待让药物和所有表达PD-L1的细胞的靶点结合,因此PD-L1抑制剂的用药剂量通常比较大,例如阿特珠单抗的推荐剂量为1200 mg。
而PD-1抑制剂只需要与所有存在PD-1靶点的免疫细胞结合,因此用药剂量会稍小一些。举例来说,纳武单抗的推荐剂量为3 mg/kg,即体重60kg的人,每次的用药剂量为180 mg。
目前来说,没有指南推荐同时使用两类药物,所以我们在这里就不讨论这两类药物的联合应用方案了。
抗血管生成抑制剂是什么
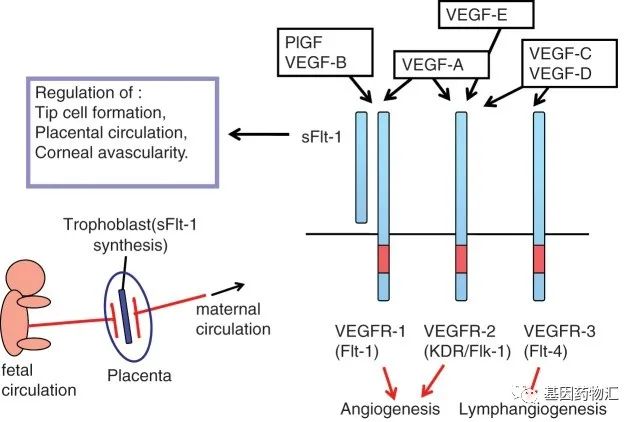
抗血管生成抑制剂属于靶向药物的一种,靶标包括血管内皮生长因子(VEGF)和血管内皮生长因子受体(VEGFR)等,治疗的主要效果为阻断血管的新生。肿瘤组织生长迅速,伴随其生长共同扩张的是大量能够为肿瘤细胞提供氧气和营养的新生血管。阻断新生血管的生成,就如同截断了一座固守的城池的“粮道”,能够达到“饿死”肿瘤的效果。
VEGF和VEGFR是一对配体,其中VEGF又分A、B、C、D、E,VEGFR又分1、2、3。它们之间具体的信号传导过程及效果很复杂,但简单来说可以理解为,对应的VEGF与对应的VEGFR相结合,触发一系列复杂的过程,肿瘤的血管就能生长;不论是抑制了哪一边,只要阻断了这种结合,就有望抑制肿瘤的血管生长。
从理论上来说,这种疗效非常美好:癌细胞的增殖与肿瘤病灶的扩张越是迅速,抗血管生成药物的疗效就应当越是明显;当然,在实际应用中,如何平衡这种抗血管生成的抗癌作用与副作用,仍是一道研究者们必须面对的难题。基于这种理论,目前已经有多款抗血管生成药问世,并顺利进入临床。
与其它靶向药物相比,抗血管生成药物最显著的优势在于,这类药物并不需要患者的癌细胞具备某种特定的突变——换句话说,不论敌人的城池里藏着的是步兵、骑兵,或者弓兵、枪兵,抗血管生成药只管断了它们的“粮草”,就完全可以起到一样的效果。
PD-L1联合抗血管,正在招募非小细胞肺癌患者
目前,一项PD-L1抑制剂联合安罗替尼,一线治疗复发或转移性晚期非小细胞肺癌患者的临床试验正在招募患者。试验允许患者既往接受过辅助化疗,需末次给药与复发时间隔至少6个月,且愿意尝试去化疗方案。
如果希望尝试临床试验,可以咨询基因药物汇获取帮助。