CAR-T治疗肝癌,靶向GPC3的CAR-T疗法治疗肝癌,晚期患者的肿瘤病灶基本消失
肝癌是最著名的“穷人癌”,因为它在发展中国家,尤其是中国高发。据统计,我国原发性肝癌的发病和死亡例数占比分别占全球的54.6%和53.9%,毫不夸张地说,我国基本上以全球20%的人口认领了超过50%的肝癌患者。
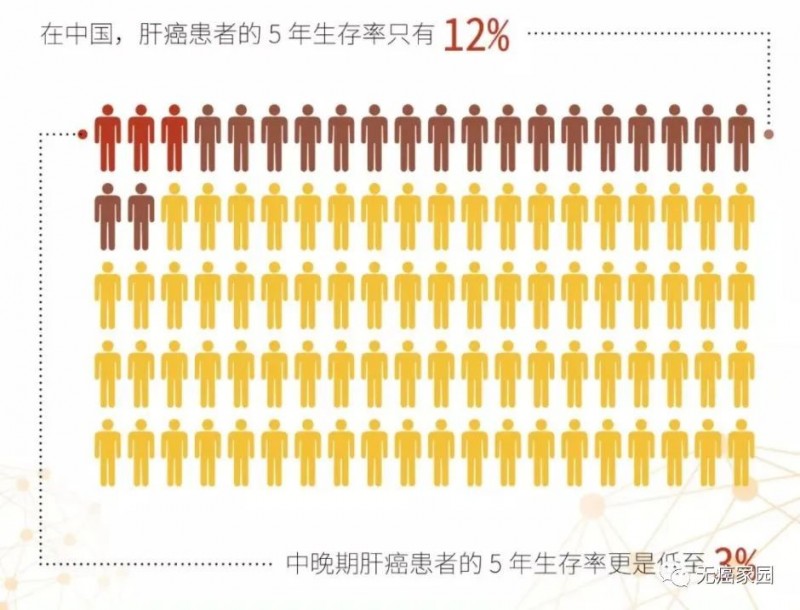
更不幸的是,我国每年死于肝癌的约34.4万人,占世界肝癌死亡人数的55%,每一分多钟就会有一人死于肝癌。相对于高死亡率,早期肝癌的发现比例却非常低,9成以上一经发现就已是晚期,此时已失去了手术治疗的机会,致使5年生存率仅为12%,中晚期肝癌患者的5年生存率更是低至3%。
中晚期肝癌患者一般已经不具有手术移植的价值,而细胞免疫治疗方式能够帮助患者提升机体免疫力,同时对于肿瘤细胞存在极强的杀伤力,对于恶性肿瘤属于一种新的治疗方式。
近年来,免疫疗法作为手术、放疗和化疗之后的“第四种疗法”,可谓是风头正盛!尤其是细胞免疫疗法在肝癌方面的临床研究一直都从未停歇,有望打破中国肝癌患者多年来的“枷锁”!
作为一种“活的”药物,嵌合抗原受体T细胞(CAR-T 细胞)疗法与传统药物有着很大的区别。它是一种治疗肿瘤的新型精准靶向疗法。通过基因工程技术将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,专门识别体内肿瘤细胞,并高效杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。与传统的化疗和造血干细胞移植相比,它对肿瘤细胞的杀伤更为精准,在提高疗效的同时大幅减轻了毒副作用。
CAR-T疗法首次应用于血液系统恶性肿瘤,取得了令人鼓舞的结果,同时,其在实体肿瘤治疗的应用中也展现出积极的效果,显示出 CAR-T细胞治疗巨大的潜力和发展前景。随着基础研究的深入、治疗理念的更新,已有研究将CAR-T细胞治疗应用于原发性肝癌。
今天无癌家园小编就列举些目前国内外已经发表的关于CAR-T疗法治疗肝癌的临床研究,以供各位癌友们参考。
疾病控制率达78%,国产CAR-T疗法在肝癌领域大展拳脚
2021年6月4日,一年一度的美国ASCO(美国临床肿瘤学会)年会上我国医学研究者们首次公布了靶向GPC3的CAR-T药物(Ori-CAR-001)治疗复发/难治性肝细胞癌的最新临床研究数据。该研究的初步数据显示,Ori-CAR-001在GPC3阳性复发/难治性患者中表现出良好安全性和有效性。
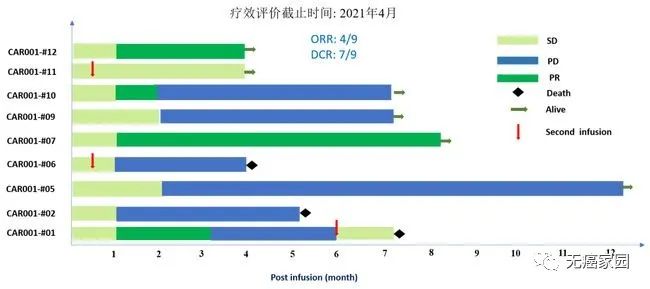
截至2021年3月10日,共纳入11名接受细胞输注的复发受试者。所有受试者均患有晚期肝细胞癌,并且经过化疗、TACE(肝动脉化疗栓塞术)和靶向治疗均无效。按照巴塞罗那分期标准,除了1例为 B期(中期)外,其余10例受试者均为 C期(晚期)。所有受试者均有多处转移病灶,其中 6 例(54%)有肺部等远处转移。2例受试者提前退组无法评估。剩余的9例可评估受试者中,4例达到部分缓解 (PR),3例达到疾病稳定 (SD),2例出现疾病进展 (PD),客观缓解率为44%,疾病控制率达到78%。
在数据截止时,受试者007的部分缓解时间6个月,其肿瘤体积在细胞治疗输注后1个月减少了80%以上。(截至2021年6月,该受试者已超过8个月的疾病控制,随访仍在进行中)。受试者012是1例弥漫型、巨块型晚期肝癌患者,曾接受过12次以上的TACE治疗、放疗及靶向治疗,不幸的是均无效,随后参与本研究。
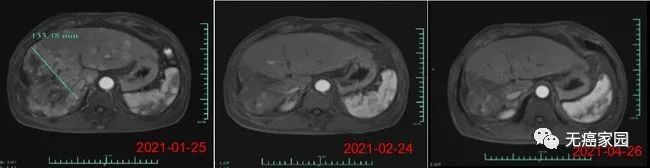
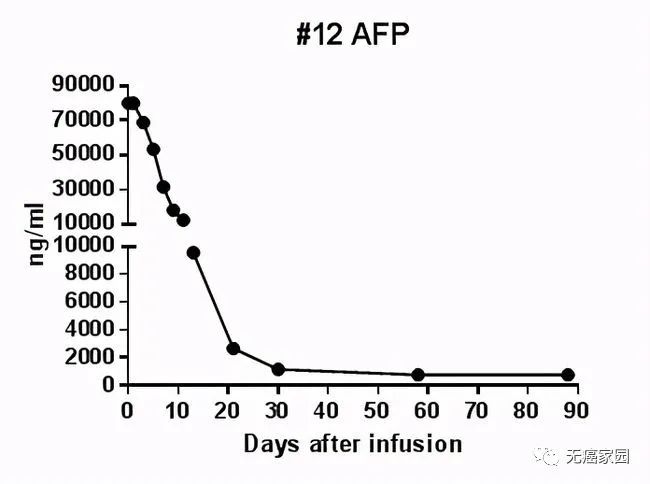
在输注CAR-T细胞后的第28天,受试者MRI结果显示最大肿瘤直径从最初的133毫米减少至9毫米,缩小超过93%。目前,该受试者正在接受CAR-T细胞输注后第3个月的评估,MRI扫描显示此肿瘤几乎消失。此外,甲胎蛋白(AFP,原发性肝癌的特定肿瘤标志物)水平从基线值 >80,000/ng/ml 下降到第1个月的1148.9ng/ml,并在第3个月下降到746.7ng/ml输注(正常范围<40ng/ml),证明Ori-CAR-001在晚期肝癌患者中具有显著的初步疗效。
受试者012的MRI结果示意图
受试者012的甲胎蛋白水平曲线图
在已回输的11例患者中,Ori-CAR-001显示出了良好的安全性和耐受性。9例患者观察到了细胞因子释放综合征(CRS),其中7例发生1-2级CRS,2例经静脉回输出现4级CRS,给予类固醇激素和托珠单抗治疗后恢复正常。没有观察到神经毒性。
改造特殊CAR-T技术,让晚期肝癌、胰腺癌病灶通通消失
针对CAR-T细胞进入肿瘤组织困难、CAR-T细胞进入肿瘤组织后容易被其他免疫抑制性的分子或细胞所阻挡无法发挥作用等问题,我国的医学研究者想到的办法是让CAR-T细胞同时分泌细胞因子和趋化因子。这些因子好比给CAR-T细胞配置了一个自带的能量马达,能够增强CAR-T细胞进入肿瘤内部的能力。
2021年7月29日,国际知名杂志《Journal of Hematology & Oncology》刊登了我国医学研究者们的一项成功改造CAR-T技术的临床研究,研究中提及的CAR-T产品选择的靶点是glypican-3(GPC3)和mesothelin(MSLN),为了使CAR-T细胞具有更强的进入肿瘤内部的能力,研究人员特地加装了白介素7(IL-7)和趋化因子CCL19。
此次研究纳入的是6例具有GPC3或MSLN表达的晚期肝细胞癌(HCC)、胰腺癌(PC)和卵巢癌(OC)患者。治疗结果格外令人惊艳!
其中1例晚期肝癌患者接受了瘤内注射CAR-T治疗,治疗后肝脏病灶代谢基本消失。
更绝的是1例晚期胰腺癌患者,接受的是静脉回输的CAR-T治疗,治疗后全身的病灶,基本都实现了代谢活性完全消失。
典型病例
01、具有GPC3表达的晚期肝细胞癌患者
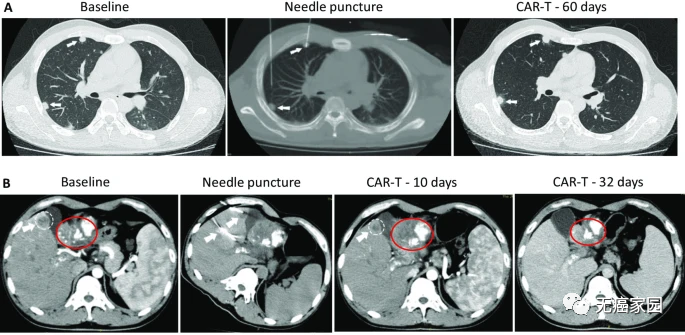
受试者GD-G/M-001是一例具有GPC3表达的晚期肝细胞癌患者,在研究中选择3个转移性病变进行计算机断层扫描(CT)引导的CAR-T细胞的瘤内注射。
CAR-T细胞注射60天后,虽然2个肺部结节的尺寸没有显著的改变,但在第10天时肝脏肿瘤病变(1.2×1.3cm)显著收缩,注射GPC3-7×19 CAR-T细胞第32天后则完全消失。
患者没有任何毒性作用,并且根据 CT 上的标准实体瘤反应评估标准 (RECIST) 1.1 版进行了分期评估,显示部分缓解 (PR)。
02、具有MSLN表达的晚期胰腺癌患者
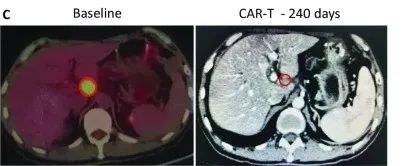
受试者GD-G/M-005 是一例具有 MSLN 表达的晚期胰腺癌患者。该受试者进展为局部淋巴结转移(24×33 mm)(图c)。抗 MSLN-7 × 19 CAR-T 细胞首先通过肝动脉输注,当晚伴有高烧,没有细胞因子释放综合征 (CRS) 或神经毒性。随后,他每1~2个月接受一次抗 MSLN-7×19 CAR-T 细胞的静脉输注。
直到增至CAR-T细胞输注的5倍,CT分期显示他在治疗240天后达到完全缓解,测定的淋巴结为8.3×9.6mm,并未见其他肿大的淋巴结(图C),患者此时病灶完全消失,保持正常状态。
无癌家园临床招募
好消息是,这种新型的CAR-T疗法在国内已正式开始招募患者了,主要评估CAR-GPC3 T细胞疗法在≥18 岁复发或难治性晚期肝细胞癌患者中的安全性及疗效。
想要参加的患者可提交病理报告、治疗经历、出院小结等资料至无癌家园医学部初步评估病情。
【入组标准(部分)】1.年龄18~75岁;2.至少有一个可评估的病灶;3.组织病理学或细胞学诊断为晚期肝细胞癌 (HCC) 的患者;先前标准全身治疗后的进展或不耐受;免疫组化(IHC)检测GPC3阳性
中国研发全球首个靶向GPC3的CAR-T疗法,初战告捷
在2020年5月5日的国际权威期刊《Clinical Cancer Research(临床肿瘤研究)》上,刊登了上海研究人员完成的世界第一个针对GPC3靶点治疗晚期肝癌的探索性CAR-T临床试验。
在两项前瞻性I期研究中,患有晚期GPC3 + HCC的成年患者(Child-Pugh A)在环磷酰胺和氟达拉滨诱导的淋巴清除后接受了自体CAR-GPC3 T细胞疗法。主要目的是评估治疗的安全性。
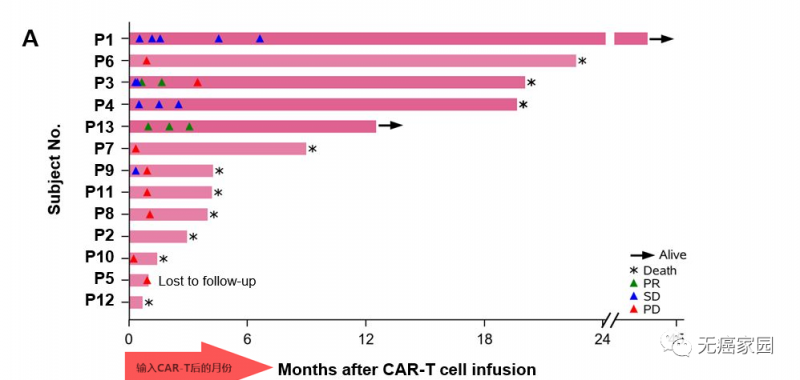
截止到2019年7月24日,共有13例患者接受了中位值为19.9×108的CAR-GPC3 T细胞。所有患者均为GPC3阳性,均接受过手术治疗、局部治疗或全身性的系统治疗,都携带乙型肝炎病毒(HBV)。
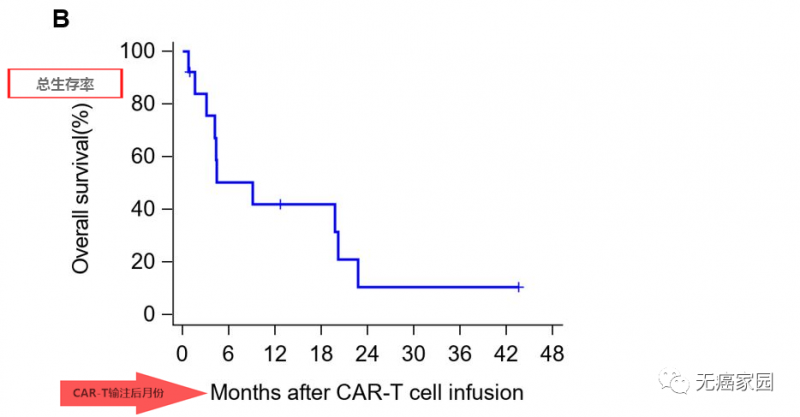
其中有2例患者获得部分缓解(PR),所有患者6个月、1年和3年的生存率分别为50.3%、42.0%和10.5%,中位生存时间(OS)为278天(39.7周)。
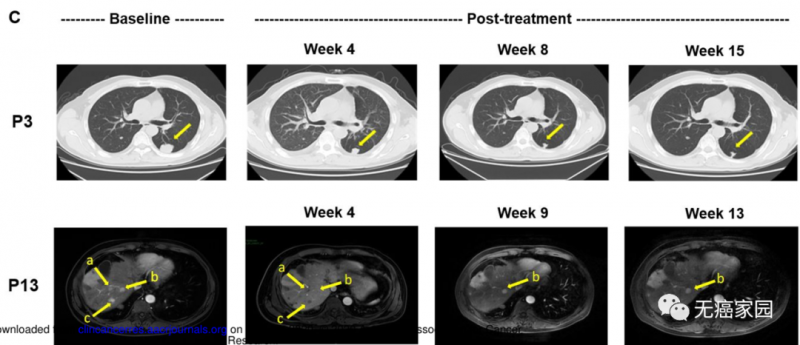
典型病例
这两例患者生存时间分别是20.5个月(图P13)和44.2个月(图P3),其中一例疾病稳定的患者至今生存期将近4年,他在入选时已有下腔静脉癌栓、右心房癌栓以及淋巴结转移,治疗后AFP(甲胎蛋白)长期维持正常水平且长期生存。
安全性
在安全性方面,主要是细胞因子释放综合征(CRS),其中8名患者出现了可逆可控的1/2级CRS,1名患者经历了5级CRS。
临床过程中,没有出现3/4级的神经毒性事件。
研究证明了CAR-GPC3 T细胞疗法的初步安全性与疗效性,值得后续深入研究。
GPC3到底是什么靶点?具有何意义?
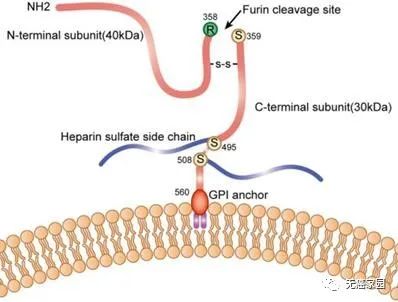
磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)在调控细胞生长和分化方面起重要作用,与肝癌的发生、发展密切相关。GPC3在肝细胞癌、卵巢透明细胞癌、卵黄囊癌等生殖系统肿瘤中表达,其在肝细胞癌中的表达率达74.8%,而在正常肝组织内几乎无表达,称为肝癌CAR-T治疗新的理想靶点。
GPC3因其肿瘤特异性,被认为是极有前景的肿瘤免疫治疗靶标。这表明在肝细胞癌中GPC3的表达越高,预后越差。
GPC3在细胞膜上的示意图
除了肝癌患者外,目前无癌家园还急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性白血病、非霍奇金淋巴瘤、胃癌、前列腺癌、甲状腺癌等癌种的患者!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
任重道远,CAR-T疗法将为更多实体瘤患者带来新的希望
截至目前,国内开展的CAR-T临床试验数量已经超过500项,居世界第一,这也是中国首次在一个新药研发领域走到国际前列。其中,传奇生物的西达基奥仑赛、斯丹赛生物的GCC19CART、科济药业的Claudin18.2 CAR-T都达到全球领先水平。此外,还有多公司在布局新一代CAR-T以及异体CAR-T技术,初步数据优异,有望获得全球市场。
2021年我国迎来了细胞免疫治疗的元年,作为先锋的CAR-T疗法,是未来发展方向之一。CAR-T疗法主要在于改造T细胞来使其识别肿瘤细胞的特殊靶点,理论上,可以有无数种针对不同靶点的CAR-T疗法,这意味着蕴含着无限可能。
希望不久的将来,能够在国内外医学科研工作者的努力下,降低细胞疗法毒副作用,降低价格,突破实体瘤的瓶颈,让越来越多的晚期癌症患者获益!
参考文献
1.https://aacrjournals.org/clincancerres/article/26/15/3979/82521/Chimeric-Antigen-Receptor-Glypican-3-T-Cell
2.https://clincancerres.aacrjournals.org/content/early/2020/05/05/1078-0432.CCR-19-3259
3.https://jhoonline.biomedcentral.com/articles/10.1186/s13045-021-01128-9#MOESM1