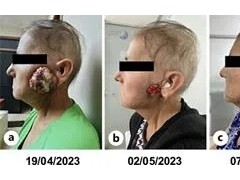
昨日,Entrectinib(恩曲替尼,Rozlytrek)获得了日本厚生劳动省(MHLW)的批准,抢先于美国FDA,首次获批。该药被批准用于治疗NTRK融合阳性,晚期复发性实体瘤的成人和儿童患者。
这是第二款不限癌种靶向NTRK基因融合的精准疗法获批,第一款是拉罗替尼,于去年11月首次获批于美国。(刚刚!针对17种癌症有效的传奇抗癌药LOXO-101震撼上市!这7个问题一定要了解!)
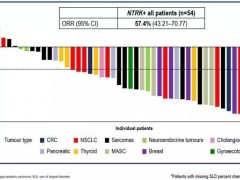
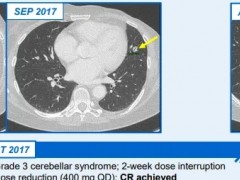
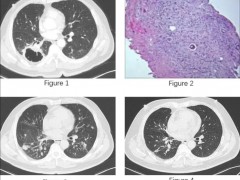
本次恩曲替尼的批准是基于多项临床试验的结果,其中包括名为STARTRK-2的关键性2期临床试验,名为STARTRK-1和ALKA-372-001的1期临床试验。对这些试验数据的汇总分析表明,在NTRK融合阳性实体瘤患者中,恩曲替尼达到57.4%的客观缓解率(ORR),中位缓解持续时间(DOR)达到10.4个月。多达10种不同类型的实体瘤患者对这一疗法产生响应。
值得注意的是,对于肿瘤转移到大脑的实体瘤患者,恩曲替尼也能达到54.5%的颅内客观缓解率,获得缓解的患者中25%达到完全缓解。
特别是在STARTRK-2中,对于NTRK阳性实体瘤患者,恩曲替尼的客观缓解率(ORR)为56.9%。在脑转移患者中,颅内客观缓解率为50%。
日本监管机构也正在审查恩曲替尼治疗ROS1融合阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者的潜在适应症。
罗氏首席医学官兼全球产品开发负责人Sandra Horning博士说:“恩曲替尼获得批准写下了个体化医疗的新篇章,让我们能够通过先进的分子诊断技术,根据患者体内的癌症驱动因子,递送精准疗法。我们为能够站在个体化医药的前沿而自豪,并且期待与全球监管机构合作,尽快将恩曲替尼带给更多NTRK融合阳性实体瘤患者,以及ROS1融合阳性NSCLC患者。”
2019年2月,美国FDA批准了一项关于恩曲替尼新药申请(NDA)的优先审查指定,用于治疗NTRK融合阳性局部晚期或转移性实体瘤的成人和儿童患者以及患者与转移性ROS1阳性非小细胞肺癌患者。预计FDA将在2019年8月18日之前做出决定,我们拭目以待。
更多治疗数据详见报道:
重磅!替代NTRK融合广谱抗癌药拉罗替尼的二代靶向药Entrectinib获得FDA优先审批
震撼!抗癌新药Entrectinib数据公布,无进展生存率100%!有望今年上市!
所以,你还在等什么,快去看看你的基因检测报告有没有这些可能带来生存奇迹的NTRK突变吧(报告解读或者重新基因检测可咨询全球肿瘤医生网医学部)!
https://www.onclive.com/web-exclusives/entrectinib-breaks-through-with-japanese-approval-for-ntrkpositive-tumors
https://www.roche.com/dam/jcr:87e8934f-32c4-42f2-832e-bb066e78c8da/en/irp20181022.pdf