套细胞淋巴瘤(MCL)是一种罕见的成熟B细胞非霍奇金淋巴瘤,是一种恶性程度高、病理组织学形态多样、预后不良的侵袭性B细胞淋巴瘤,好发于中老年男性,中位发病年龄60~65岁,多数患者诊断时为Ⅲ~Ⅳ期(癌细胞已扩散至淋巴结、骨髓和其它器官),且该病易复发,预后差。一线治疗通常为R-HyperCVAD方案或R-EPOCH方案,如果条件允许,初次治疗后应进行自体造血干细胞移植,但对于复发及难治性套细胞淋巴瘤,但依然没有国际公认的治疗方案。
Bruton酪氨酸蛋白激酶(BTK)
Bruton酪氨酸蛋白激酶(Bruton’s tyrosine kinase,BTK)是B细胞受体通路重要信号分子,在B淋巴细胞的各个发育阶段表达 ,参与调控B细胞的增殖、分化与凋亡,在恶性B细胞的生存及扩散中起着重要作用,BTK在B淋巴细胞的生成过程中起着不可替代的作用,可作为治疗血液肿瘤的理想靶点。它也是是目前临床研究治疗B细胞类肿瘤及B细胞类免疫疾病的研究热点。
伊布替尼(ibrutinib)
伊布替尼(ibrutinib)是一种有效的口服BTK抑制剂,由强生和Pharmacyclics合作开发,是2013年FDA批准的全球第一个上市的BTK抑制剂,作为治疗B细胞淋巴瘤和慢淋白血病(CLL)的突破性疗法。单药抗套细胞淋巴瘤(MCL)活性好,毒性小,适应症包括慢性淋巴细胞白血病、小淋巴细胞性淋巴瘤、套细胞淋巴瘤、Waldenström巨球蛋白血症等,也是全球最畅销的白血病药物,CFDA在2017年9月批准伊布替尼Ibrutinib在中国上市。
DTRMWXHS-12
DTRMWXHS-12是由浙江导明医药科技有限公司研发的BTK抑制剂类小分子靶向抗肿瘤药。临床申报于2015年7月获受理,后经特殊审评于2016年5月获准临床。评估BTK激酶抑制剂DTRMWXHS-12在B-细胞淋巴瘤患者中的安全性、耐受性、药代动力学的Ⅰa期临床研究于2017年10月29日在第二届中国医药创新投资大会上,由浙江导明医药科技有限公司创始人何伟首次公布。
DTRMWXHS-12是导明医药研发的新型BTK抑制剂,根据药代动力学(PK)研究结果显示,DTRMWXHS-12比伊布替尼更有优势,可以为具有有效剂量依赖性副作用特征的患者提供一致疗效。从导明医药开展的小分子组合合成致死性临床前研究发现,细胞多个关键信号通路中BTK和mTOR的抑制与免疫调节(IMID)组合可以改善选择性细胞杀伤并避免获得性耐药。
DTRMWXHS-12在中国开展了针对标准疗法治疗无效的难治/复发性B细胞淋巴瘤的Ia期临床试验(NCT02891590),以50、100、200和400毫克4个剂量组,进行了剂量递增试验,共入组13例,完成试验10例。结果显示DTRMWXHS-12所有剂量组患者血药浓度均高于伊布替尼,患者间差异也明显小于伊布替尼,没有观测到最大耐受剂量(MTD),也没有发生剂量限制性毒性(DLT),显示DTRMWXHS-12单药治疗具有良好的耐受性。
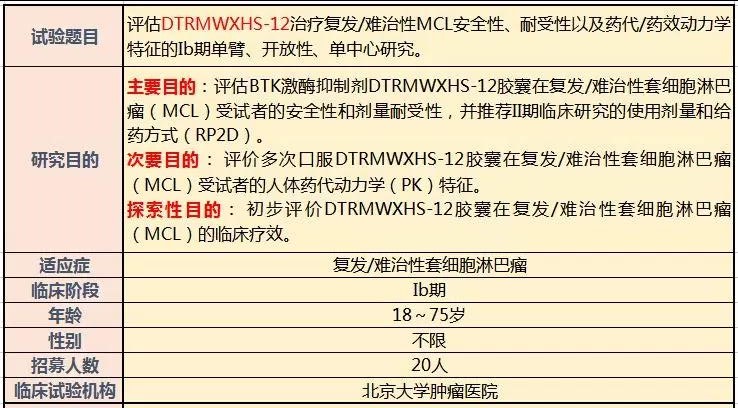
目前,国内正在开展一项临床研究,评估BTK激酶抑制剂DTRMWXHS-12胶囊在复发/难治性套细胞淋巴瘤(MCL)受试者的安全性和剂量耐受性,并推荐II期临床研究的使用剂量和给药方式(RP2D)。本次临床招募已经在中国国家食品药品监督管理总局登记注册,登记注册号:CTR20181865。全球肿瘤医生网可协助淋巴瘤患者申请参加临床试验,详情登录或点击在线咨询。以下是部分招募信息!
试验信息简介
入选标准
1 年龄18~75岁(含两端),性别不限。
2 必须有通过计算机断层扫描(CT)/核磁共振成像(MRI)显示可测量病灶。可测量病灶定义为至少1个淋巴结的最长径大于1.5 cm,而且有两个垂直方向上清晰可测,或至少一个结外病灶最长直径大于1 cm(如肝结节),如仅累积脾脏或胃肠黏膜,依据研究者判断进行相应的检查和评估。
3 诊断报告必须包括形态学和细胞周期蛋白D1免疫组化阳性或t(11;14)的证据。以上结果由免疫组化、细胞遗传学或荧光原位杂交(FISH)来检测。入组之后,肿瘤组织(FFPE)块或切片必须送往中心实验室来确定MCL的诊断。
4 实验室参数如下所示:a. 血常规:进入研究前7天内中性粒细胞≥1.0×10^9/L,且无生长因子支持或输血,血小板≥75×10^9/L(若有骨髓受累,血小板≥50×10^9/L ),血红蛋白>9g/dL。
5 东部肿瘤协作组(ECOG)体能状况评分为0~2。
6 预期寿命>3个月。
7 必须有淋巴瘤系统性治疗后复发,难治或疾病进展的书面记录;接受过至少一种且少于五种套细胞淋巴瘤既往治疗(1≤既往治疗方案数<5个)。
8 最近采用的治疗方案确认无缓解(治疗期间病情稳定[SD]或疾病进展),或在治疗后确认发生疾病进展。
9 自体造血干细胞移植后至少3个月疾病复发的受试者可以入选研究。可入选的前提是受试者不得患有活动性相关感染。
10 有生育能力的女性受试者必须同意在研究期间和研究药物末次给药后至少180天内采用高效的避孕措施。高效的避孕措施包括禁欲、子宫切除、双侧卵巢切除且持续6个月无月经出血、宫内节育系统、激素避孕法,例如注射避孕药、口服避孕药等。男性受试者必须绝育,即输精管切除,或者采用屏障法,同时女性伴侣采用上述有效的避孕措施。
11 可以签署知情同意书,并可以理解并遵守研究各项要求。
排除标准
1 患有中枢神经系统(CNS)淋巴瘤或存在此类病史。
2 入组曾接受过BTK抑制剂治疗的患者。在研究药物开始给药7天内接受过类固醇激素(剂量相当于泼尼松 > 20 mg/天)抗肿瘤治疗类药物,4周内进行过化疗、靶向治疗或放疗,或4周内使用过中草药抗肿瘤药物或抗体治疗。
3 筛选前4周内进行过大手术(由研究者根据受试者情况判定)。
4 3-6个月内发生活动性出血或合并应用抗凝治疗。
5 前期接受过化疗而毒性仍未恢复者(根据NCI-CTCAE 4.03毒性没有恢复到≤1级,脱发、中性粒细胞绝对计数(ANC)和血小板除外)。对于中性粒细胞和血小板,请参考第4条[中性粒细胞]和[血小板]入选标准)。
6 进入研究前2年内存在其他活动性恶性疾病病史,以下情况例外:(1)经过恰当治疗的原位宫颈癌;(2)局部皮肤基底细胞癌或鳞状细胞癌;(3)得到控制并且经局部根治性治疗(手术或其他形式)的既往恶性疾病。
7 目前患有临床意义的活动性心血管疾病,如未经控制的心律失常、充血性心力衰竭、按照纽约心脏病协会(NYHA)功能分级确定的任何3级或4级心脏病,或在筛选前6个月内存在心肌梗死病史。
8 QTcF>450 msecs或其他显著的心电图异常,包括二度II型房室传导(AV)阻滞或三度AV阻滞。
9 不能吞服胶囊或存在显著影响胃肠道功能的疾病,例如吸收不良综合征、胃或小肠切除、症状性炎性肠病,或者部分或完全肠梗阻。
10 未经控制的全身性感染或需要静脉注射抗菌药治疗的感染。
11 既往异体干细胞移植者。
12 已知患有人类免疫缺陷病毒(HIV)感染,或者活动性乙型或丙型肝炎病毒感染(聚合酶链反应[PCR]或逆转录-聚合酶链反应[RT-PCR]显示阳性结果)。
13 乙肝检测包括HBsAg、HBcAb、HBsAb,如果受试者HBsAg阴性但HBcAb阳性(不考虑HBsAb状态),则采用PCR技术检测乙肝病毒(HBV)DNA,表格中的可接受正常上限为1000 IU/ml,因为各中心所用的PCR试剂盒不同,HBV DNA检测的可接受正常上限应以各中心检测的正常值为准。丙肝检测包括丙肝病毒(HCV)抗体,如果患者的HCV抗体阳性,则采用RT-PCR技术检测HCV RNA 。(入选---HIV:Antibody(-);HBV:HBsAg(-)或HBsAg(-)HBcAb(+)但HBV DNA<1000IU/ml,入组后每个月进行一次HBV DNA检查或服用抗病毒药物;HCV:Antibody(-)或Antibody(+)但HCV RNA<1(log10IU/ml),每月复检或服用抗病毒药物。排除-- HIV:Antibody(+);HBV:HBsAg(+)或HBsAg(-)HBcAb(+)但HBV DNA≥1000IU/ml;HCV:Antibody(+)但HCV RNA>1(log10IU/ml)。)
14 孕妇或哺乳期妇女。
15 任何被研究者认为可能影响受试者安全或导致研究风险的危及生命的疾病、医学状况或器官系统功能不全
16 依从性差的受试者。
17 入组7天内接受细胞色素P450第3家族A亚组(CYP3A)的强效抑制剂或CYP3A强效诱导剂的药物治疗。
参加中心
|
机构名称 |
主要研究者 |
城市 |
|
北京大学肿瘤医院 |
朱军/宋玉琴(淋巴肿瘤内科) |
北京市 |
随着医学的不断进步,新型有效的抗癌药物及技术不断涌现。请广大癌症患者及时接受正规治疗,如果经济条件允许,请国外专家诊断治疗也是很好的选择!